下列对各组离子或物质是否能够大量共存解释正确的是 ( )
| A |
常温常压下NH3、O2、H2、CO2 |
不能共存 |
NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B |
c(OH-)=1×10-13mol/L溶液中,Fe2+、NO3-、SO42-、Na+ |
不能共存 |
发生反应Fe2++NO3-+4H+=3Fe3++NO+2H2O |
| C |
溶液中: K+、Cu2+、Cl-、NH3•H2O |
不能共存 |
发生反应Cu2++2OH-=Cu(OH)2 |
| D |
溶液中Al3+、Na+、SO42-、HCO3- |
可以共存 |
不能发生反应 |
下列各组物质,前者是混合物,后者是纯净物的是
| A.明矾、玻璃 | B.汽油、液氯 |
| C.漂白粉、盐酸 | D.干冰、铝热剂 |
将下列物质按酸、碱、盐分类顺序排列正确的是
| A.硫酸、纯碱、石膏 | B.氢硫酸、烧碱、绿矾 |
| C.醋酸、乙醇、醋酸钠 | D.磷酸、熟石灰、苛性钾 |
下列各组物质中均属于氧化物的是
| A.SO2、CO、H2O | B.MnO2、NaOH、Fe2O3 |
| C.Fe2O3、Fe3O4、O3 | D.O2、KClO3、H2SO4 |
下列变化属于物理变化的是
| A.O2在放电条件下变成O3 | B.加热胆矾成无水硫酸铜 |
| C.漂白的草帽久置于空气中变黄 | D.用干冰降雨 |
下列关于右图所示装置的叙述正确的是 ( )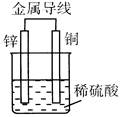
| A.锌是正极 | B.铜片质量逐渐减少 |
| C.铜片表面发生还原反应 | D.电流从锌片经导线流向铜片 |