(16)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为 mol。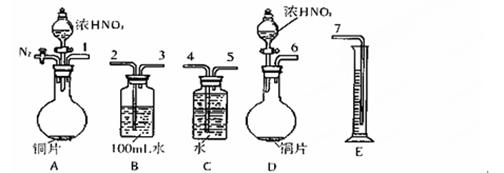
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号) 。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标准状况),则Cu与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
(4)实验前,用托盘天平称取的铜片至少应为 g。
(每空2分,共12分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: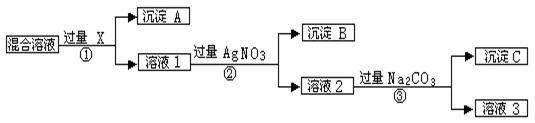
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X :,沉淀A:,沉淀B:。
(2)上述实验流程中加入过量的Na2CO3的目的是
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: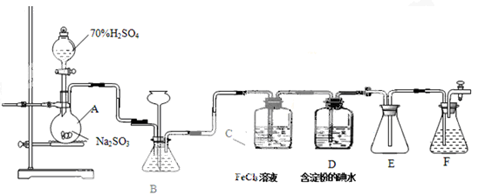
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若,则整个装置气密性良好。装置E的作用是。装置F中为溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
| A.蒸馏水 | B.饱和Na2SO3溶液 |
| C.饱和NaHSO3溶液 | D.饱和NaHCO3溶液 |
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是___________,写出有关离子方程式:______________。
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行: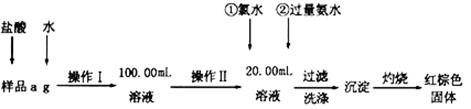
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为;
(3)若不用氯水,可用下列试剂中的代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含
(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含___所致。
3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
| A.酚酞试液 | B.CCl4 | C.无水酒精 | D.KSCN溶液 |
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
____________________________。
②在FeBr2溶液中通入足量Cl2,所发生的离子反应方程式为。
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体,以证明+6价S的氧化性强于+1价H。
(1)填写装置的作用: B, C,G。
(2)证明有SO2生成的现象是
(3)可以证明气体X中含有氢气的实验现象是:E中:__________________,F中:__________________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或 “不能”),原因是______
。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是,要确认CuSO4生成,待试管冷却后,。