反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
| A.υ(X)=0.05mol·L—1·min—1 | B.υ(Y)= 0.10mol·L—1·min—1 |
| C.υ(Z)=0.10mol·L—1·min—1 | D.υ(W)=0.05mol·L—1·s—1 |
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?) + Y(?)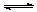 aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是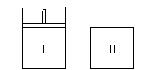
| A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间Ⅰ>Ⅱ |
| D.平衡时Ⅰ容器的体积小于VL |
在密闭容器中,对于可逆反应A+3B  2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是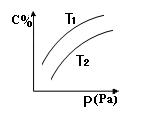
| A.A一定为气体 |
| B.B一定为气体 |
| C.该反应是放热反应 |
| D.若正反应方向△H <0,则T1>T 2 |
下列实验操作正确的是
| 编号 |
实验 |
操作 |
| A |
观察钠与水反应 的现象 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B |
配制一定物质的量浓度的氯化钾溶液 |
准确称取一定质量的氯化钾固体,放入到1000mL的容量瓶中,加水1000mL溶解,振荡摇匀。 |
| C |
稀释浓硫酸 |
将蒸馏水沿烧杯内壁慢慢注入盛浓硫酸的烧杯中,并用玻璃棒不断搅拌,使产生的热量不断散失 |
| D |
取出分液漏斗中 的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
甲烷燃料电池(电解质溶液是KOH溶液)的总反应为:
CH4+2KOH+2O2 = K2CO3 + 3H2O。下列有关的说法中不正确的是
| A.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大 |
| B.该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化 |
| C.负极反应式:CH4+3H2O-8e-=CO32-+7H+ |
| D.正极反应式:2O2+4H2O+8e-=8OH- |
实验室里需用480 mL 0.1 mol/L的硫酸铜溶液,现选取进行配制,以下操作正确的是
| A.480 mL容量瓶,称取7.68 g硫酸铜,加入500 mL水 |
| B.500 mL容量瓶,称取12.0 g胆矾配成500 mL溶液 |
| C.480 mL容量瓶,称取8.0 g硫酸铜,加入500 mL水 |
| D.500 mL容量瓶,称取12.5 g胆矾配成500 mL溶液 |