Ⅰ.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
—— |
(1)铝热反应方程式为 。
(2)下列能与Al发生铝热反应的有 。(填序号)
A、MnO2 B、Na2O C、MgO D、FeO
(3)据上表数据该同学推测,铝热反应所得到的熔融物应是铁铝合金。若证明上述所得的块状熔融物中含有金属铝,所用试剂是 。
Ⅱ.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的实验仪器有________等。(填代号,下同)
A 试管 B 坩埚 C 烧杯 D 三角架
E、泥三角 F、洒精灯 G、铁架台 H、量筒
第2步:Iˉ溶液的获取。操作是将灰烬转移到烧杯中,加适量蒸馏水溶解,该过程为加快溶解可以采取哪些措施 。此操作后的分离方法________。(填分离方法)
(3)第3步:氧化。取(2)中溶液少量依次加入合适的试剂。下列氧化剂最好选_________。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加_______溶液,证明海带中含碘。
向含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中错误的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2∶1时,还原产物可能是
| A.N2O | B.NO | C.NO2 | D.N2 |
相同溶质的两份溶液,一份质量分数为ω1,密度为ρ1 g/cm3,浓度为a mol/L,另一份质量分数为ω2,密度为ρ2 g/cm3,浓度为b mol/L,若2a=b,2ω1>ω2,则ρ1与ρ2的大小关系是
| A.ρ1=ρ2 | B.ρ1>ρ2 | C.ρ1<ρ2 | D.无法比较 |
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断,错误的是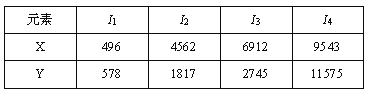
| A.元素X的常见化合价是+1价 |
| B.元素Y是IIIA族元素 |
| C.元素X与氯形成化合物时,化学式可能是XCl |
| D.若元素Y处于第三周期,它可与冷水剧烈反应 |
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |