X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。 请回答下列问题:
(1)X元素的名称是________________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________。
(3)写出F的电子式______________________________。
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式___________, ;
B中含有的化学键是 ;请举一例说明B的用途_____________。
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
(12分)
雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al ▲Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: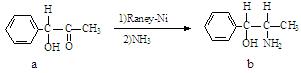
化合物b中进行sp3杂化的原子有: ▲。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是: ▲(选填序号)。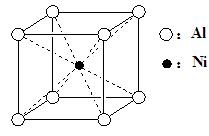
a.氯化钠b.氯化铯c.石英d.金刚石
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: ▲。
②在配合物中用 化学键和氢键标出未画出的作用力(镍的配位数为4)。
化学键和氢键标出未画出的作用力(镍的配位数为4)。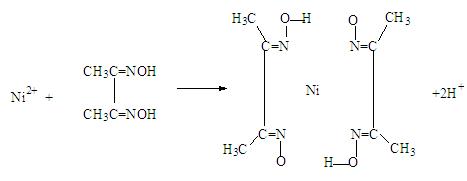
β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下: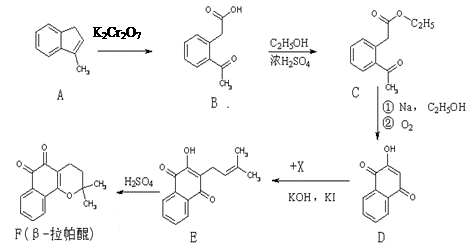
(1)已知X的分子式为C5H9Cl,则X的结构简式为: ▲。
(2)反应类型A→B ▲。
(3)上述反应中,原子利用率达100%的是 ▲(选填:“A→B”、“B→C”、“D→E”、“E→F”)。
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为: ▲。
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有 ▲种(不包括立体异构)。
①属于苯的衍生物②苯环上有两个取代基
③分子中含有一个手性碳原子④分子中有一个醛基和一个羧基
(6)已知:双烯合成反应: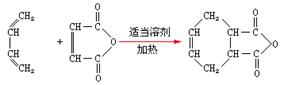 ,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
,试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子 。
。
[提示]合成路线流程图示例如下: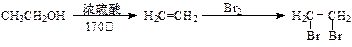
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4] ―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
[方法一]还原法在酸性介质中 用FeSO4等将+6价铬还原成+3价铬。
用FeSO4等将+6价铬还原成+3价铬。
具体流程如下: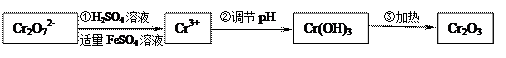
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0[ |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 ▲。
▲。
(2)还原+6价铬还可选用以下的 ▲试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为: ▲(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在 ▲(填序号)最佳。
A.3~4  B.6~8 C.10~11 D.12~14
B.6~8 C.10~11 D.12~14
[方法二]电解法将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极 的电极反应式 ▲。
的电极反应式 ▲。
(5)电解法中加入氯化钠的作用是: ▲。
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l)△H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l)△H=-103.7 kJ·mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是 ▲。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l)△H1
H2NCOONH4(氨基甲酸铵) (l)△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)△H2
H2O(l)+H2NCONH2(l)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,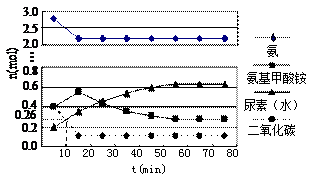

图Ⅰ图Ⅱ
实验测得反应中各组分随时间的变化如下图Ⅰ所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲步反应决定,总反应进行到 ▲min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲0(填“>”“<”或“=”)
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示: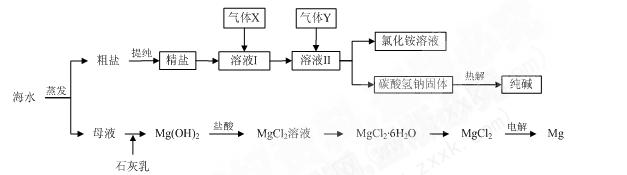
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO 3溶液;⑤ ▲;⑥加适量的盐酸;⑦ ▲。
3溶液;⑤ ▲;⑥加适量的盐酸;⑦ ▲。
(2)溶液Ⅱ中发生反应的化学方程式是: ▲。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用 ▲溶液进行洗涤以除之。
(4)高温灼烧六水 合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式 ▲。
合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式 ▲。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为: ▲。