在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
| A.在该条件下,反应前后的压强之比为6 :5.3 |
| B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3) < 1.4mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。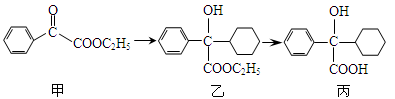
下列说法正确的是
| A.化合物甲的分子式为C10H10O3,分子中的含氧官能团有醛基和酯基 |
| B.化合物乙能发生消去反应,且生成的有机物能和溴发生加成反应 |
| C.化合物乙与NaOH水溶液在加热条件下反应生成化合物丙 |
| D.化合物丙能和氯化铁溶液发生显色反应 |
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
| B.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| C.高压比常压有利于合成SO3的反应 |
D.对CO(g) + NO2 (g)  CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,18gD2O中所含的质子数为10NA |
| B.标准状况下,11.2LO2参加反应转移的电子数一定为2 NA |
| C.28gN2和CO的混合气体中含有的分子数为NA |
| D.5.6g铁与足量稀硫酸反应失去电子数为0.3 NA |
生活中的一些问题常涉及到化学知识,下列叙述不正确的是
| A.维生素C具有还原性,在人体内起抗氧化作用 |
| B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 |
| C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 |
| D.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
| 酸 |
醋酸 |
次氯酸 |
碳酸 |
亚硫酸 |
| 电离平衡常数 |
K a=1.75×10-5 |
K a=2.98×10-8 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为: SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO