卡托普利(E)是用于治疗各种原发性高血压的药物,合成路线如下: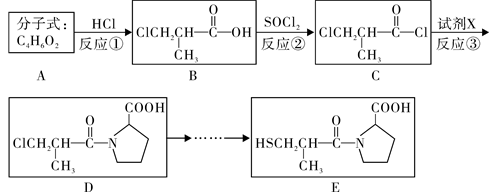
(1)A的系统命名 ,B中官能团的名称是 ,B→C的反应类型是 。
(2)C→D转化的另一产物是HCl,则试剂X的分子式 。
(3)D在NaOH醇溶液中发生消去反应,经酸化后的产物Y有多种同分异构体,写出同时满足下列条件的物质Y的同分异构体的结构简式 、 。
a.红外光谱显示分子中含有苯环,苯环上有四个取代基且不含甲基
b.核磁共振氢谱显示分子内有6种不同环境的氢原子
c.能与FeCl3溶液发生显色反应
(4)B在氢氧化钠溶液中的水解产物酸化后可以发生聚合反应,写出该反应的化学方程式 。
某吸水材料与聚酯纤维都是重要化工原料,它们的合成路线如下: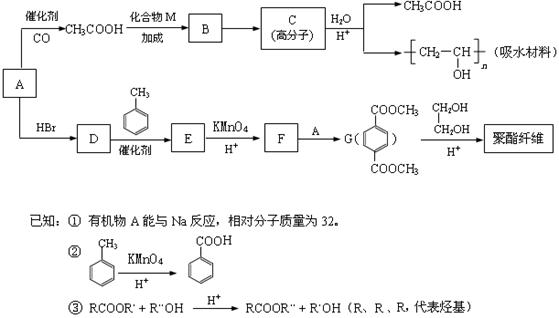
(1)A的结构简式是,B中含氧官能团的名称是。
(2)C的结构简式是,D → E的反应类型是。
(3)F + A → G的化学方程式是。
(4)CH3COOH + CH≡CH → B的化学方程式是。
(5)G的同分异构体有多种,满足下列条件的共有种。
①苯环上只有两个取代基
②1 mol 与足量的NaHCO3溶液反应生成2 mol CO2气体
(6)G → 聚酯纤维的化学方程式是。
【化学-选修5:有机化学基础】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症、老年痴呆有良好的疗效。由环戊二烯合成金刚烷的路线如下:
请回答下列问题:
(1)金刚烷的分子式为__________________________________。
(2)反应①的反应类型是________________________________________。
(3)金刚烷与四氢二聚环戊二烯的关系是_____________。(填字母)
a.互为同系物 b.互为同分异构体 c.均为烷烃 d.均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应②的反应试剂和反应条件是_______________;X的名称是______________;反应4的化学方程式是_____________________________________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3,-CH2R,-CHR2)或烯基侧链经高锰酸锌酸性溶液氧化得羧基],则A的结构有__________种(不考虑立体异构)。
[化学—选修5:有机化学基础]已知B和E分别是生产酚醛树脂和有机玻璃的重要原料。工业上生产B和E的一种途径是:
①A为苯的同系物,其一氯代物有5种;
②C、D、E的核磁共振氢谱图中,峰的个数分别为1,2,3;
③等量的E分别与足量的Na和足量的NaHCO3溶液反应,在相同条件下,生成的气体气体相同。
回答下列问题:
(1)C分子中所含官能团的名称是。
(2)C→D的反应类型是。
(3)A的结构简式为,A的含有苯环的同分异构体(除A外)有种。
(4)糠醛(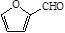 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式。
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式。
(5)E有多种脱水产物,其中F具有六元环状结构,G是一种聚酯高分子材料,写出F和G的结构简式。
F:G:
已知:共轭二烯烃(如1,3-丁二烯)可以发生如下两种加成反应:
请以苯酚为原料,其他无机试剂任选,合成 ,写出正确的合成路线:
,写出正确的合成路线:
__________________________________________________________________________
_________________________________________________________________________。
【化学—选修5:有机化学基础】
盐酸普鲁卡因(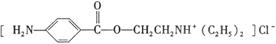 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
已知:①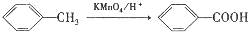
②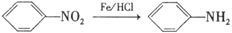
③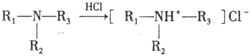
请回答以下问题:
(1)A的核磁共振氢谱只有一个峰,则A的结构简式为____________________。
(2)C的结构简式为__________,C中含有的含氧官能团的名称为__________。
(3)合成路线中属于氧化反应的有_____________(填序号),反应③的反应类型为________________。
(4)反应⑤的化学反应方程式为______________________________________________。
(5)B的某种同系物E,相对分子质量比B大28,其中—NO2与苯环直接相连,则E的结构简式为____________________(任写一种)。
(6)符合下列条件的E的同分异构体的数目有__________种。
①结构中含有一个“—NH2”与一个“—COOH”
②苯环上有三个各不相同的取代基
(7)苯丙氨酸(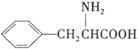 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。