汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3  K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
| A.生成40.0LN2(标准状况) | B.有0.250molKNO3被氧化 |
| C.转移电子的物质的量为1.25mol | D.被氧化的N原子的物质的量为3.5mol |
同温同压下,三个等体积的干燥圆底烧瓶中分别充满①HCl ②NO2 ③体积比为1:1的NO2和O2,进行喷泉实验。经充分反应后烧瓶内溶质的物质的量浓度之比为
| A.1: 1 :1 | B.4: 4 :5 | C.5: 5 :4 | D.15: 10 :12 |
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
| A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
| B.若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 |
| C.若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
| D.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
设NA表示阿伏加德罗常数的值,下列说法中不正确的
| A.2克16O2和14N2的混合气中含有的电子数为NA个 |
| B.1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
| C.Na2O和Na2O2的混合物中若含有1mol Na+,则其含有阴离子总数为0.5NA |
| D.常温下,1.0 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是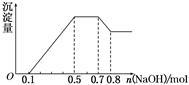
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2 mol |
| C.溶液中一定不含CO32-,可能含有SO42-和NO3- |
| D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1 |
向30 mL 1 mol/L的AlCl3溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为
| A.3 mL | B.7.5 mL | C.15 mL | D.17.5 mL |