镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
| A.充电过程是化学能转化为电能的过程 |
| B.放电时电解质溶液中的OH-向正极移动 |
| C.充电时阳极反应:Ni(OH)2-e— + OH- ="=" NiOOH + H2O |
| D.放电时负极附近溶液的碱性不变 |
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,X是短周期中除稀有气体元素外半径最大的元素。下列说法正确的是
| A.若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B.Y的最高价氧化物对应的水化物一定是碱 |
| C.稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D.X、Y的氧化物晶体类型一定相同 |
下列说法正确的是
| A.用标准NaOH标准液滴定盐酸,尖嘴部位滴定前无气泡,滴定后有气泡,则滴定结果偏大 |
| B.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
| C.比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
| D.自来水厂常用某些含铝或铁的化合物作净水剂,是由于这些物质具有杀菌消毒作用 |
下列说法正确的是
| A.用氨水法处理燃煤烟气中的二氧化硫,既可消除其污染,又可得到副产品硫酸铵 |
| B.光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 |
| C.赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D.肌红蛋白、蚕丝、过氧化氢酶、鱼肝油充分水解后均可得到氨基酸 |
某强酸性溶液中仅含有Ba2+、Al3+、Fe3+、Fe2+、NH4+、CO32-、SO32-、SO42-、Cl-、NO3-等离子中的一种或几种,取溶液进行下列连续实验,实验内容如下: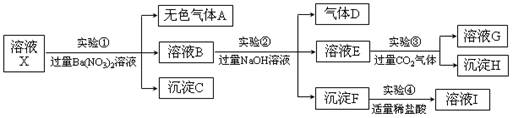
请指出下列说法正确的是
| A.沉淀C可能是单一组分,也可能是混合组分 |
| B.根据沉淀F可推测溶液X中一定含有Fe3+ |
| C.以上实验无法确定溶液X中是否含有NO3- |
| D.溶液I与溶液G混合,会产生气体和红褐色沉淀 |
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。如图为向该溶液中通入HCl气体或加入NaOH固体时(不考虑溶液温度变化),溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法不正确的是
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,A-的水解程度增大,HA的电离常数减小
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)