反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表。
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表。
| 温度(K) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
下列说法正确的是( )
A.反应①是放热反应 B.反应②是放热反应
C.反应②在973 K时增大压强,K2增大 D.在常温下反应① 一定能自发进行
如图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是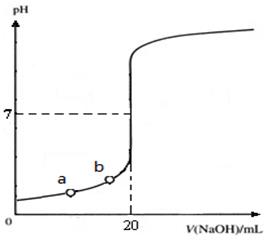
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为0.0100 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应,溶液刚好显中性 |
| D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3 |
下列各组数据关系中,前者比后者大的是
| A.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目 |
| B.常温下pH=4的KHSO4溶液和CH3COOH溶液中由水电离出的OH—离子浓度 |
| C.纯水在100℃时的pH和25℃时的pH |
| D.100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+浓度 |
某原电池装置如右图,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
| A.在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是
A.稀释前,c(A)=10 c(B)
B.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
C.稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L
D.由图可知,A为强碱、B为弱碱