设NA为阿伏加德罗常数的值。下列说法不正确的是
| A.常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B.15 g C2H6含C—H键数目为3NA |
| C.28 g乙烯与丙烯的混合气体,含碳原子总数为2NA |
D.7.8 g 中含有的碳碳双键数目为0.3NA 中含有的碳碳双键数目为0.3NA |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+ |
| B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3- |
| C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| D.c(SO32-)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+ |
下列有关物质的性质和该性质的应用均正确的是
| A.SO2具有氧化性,可用于漂白纸浆 |
| B.炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.BaCO3、BaSO4都难溶于水,均可用做钡餐 |
| D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
B.乙炔的分子结构模型示意图: |
C.H2O2的电子式: |
D. 的名称3-甲基-1-丁醇 的名称3-甲基-1-丁醇 |
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
| A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
| B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化 |
| C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念 |
| D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下: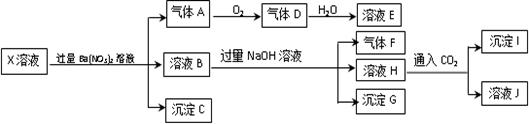
下列说法正确的是
| A.气体A是NO2 |
| B.X中肯定存在Fe2+、A13+、NH4+、SO42- |
| C.溶液E和气体F不能发生化学反应 |
| D.X中不能确定的离子是 A13+和C1- |