用NA表示阿伏加德罗常数的数值,下列叙述正确的是
①0.84 g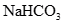 晶体中阴离子数为0.01NA
晶体中阴离子数为0.01NA
②常温下,1L0.1 mol·L-1 Na2CO3溶液中阴离子数目之和大于0.1 NA
③常温常压下,0.3molCl2通入水中,充分反应后转移电子数目为0.3 NA
④7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1 NA
⑤标准状况下,22.4LSO3的分子数为NA
⑥标准状况下,22.4LNO和11.2L O2混合后气体的分子总数等于NA
| A.①②③ | B.①②④ | C.②④⑥ | D.③④⑤ |
在一定体积的容器中,加入1.5mol氙气(Xe)和7.5mol氟气(F2),于400℃2633kPa 压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气(F2),则所得的无色晶体产物中,氙和氟的原子个数比为 ()
| A.1:2 | B.1:3 | C.1:4 | D.1:6 |
一块表面已被氧化为Na2O的钠块7.7g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是()。
| A.9.2g | B.10.6g | C.6.2g | D.2.3 g |
金属钠长期暴露在空气中,它的最 终产物是 ( )
终产物是 ( )
| A.Na2O2 | B.NaOH  |
C.Na2CO3 | D.NaHCO3 |
除去CO中少量的CO2,选用的试剂和装置均正确的是( )
某药品说明书中标明:本品每克含碘15mg,镁65mg,铜2mg,锌1.5mg,锰1mg,这里所标的各成分是()
| A.分子 | B.元素 | C.单质 | D.离子 |