(10 分)游泳池水的含氯气量应该控制在0.5mg/L至1.0 mg /L之间,
(1)写出氯气溶于水后的化学方程式 。
(2)你认为哪几天的天气炎热、阳光强烈 ,理由是 。(用化学方程式表示)
(3)小型泳池通常使用次氯酸钠溶液而非氯气来消毒池水,试举出使用次氯酸钠溶液而非氯气的一项理由 。用化学方程式说明工业上如何生产次氯酸钠溶液 。
元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
E |
F |
||||||
| 3 |
A |
C |
D |
G |
R |
|||
| 4 |
B |
H |
(1)这9种元素中金属性最强的元素是______,化学性质最不活泼的是______(填元素符号,下同);
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为___________;
(4)F元素氢化物的化学式是_________,该氢化物在常温下跟B发生反应的化学方程式是,所得溶液的PH_______7;
(5)H元素跟A元素形成的化合物的化学式是_______,高温灼烧该化合物时,火焰呈现_______色;
(6)G元素和H元素两者核电荷数之差是_________
如图示的原电池中, 
(1)铜极为原电池的(填“正”或“负”)极,该极的电极反应式是,属于(填“氧化反应”或“还原反应”)。
(2)如铁棒质量减轻5.6 g,则另一极放出气体的体积为L(标准状况)。
影响化学反应速率的因素很多。在下列事实中,影响反应速率的外界条件分别为:
(1)夏天的食品易霉变,冬天不易发生该现象;
(2)在5﹪的H2O2溶液中加入1滴~2滴1mol∕LFeCl3溶液,很快产生气体 ;
(3)工业上常将固体燃料粉碎,以提高燃烧效率;
(4)硫在氧气中比在空气中燃烧更快;
(5)工业合成氨通常要在高压下进行。
下图是各物质的反应关系图:已知A和E都是黄色粉末.F有刺激性气味且有漂白性常被不法商人用来漂白腐竹等.请据此回答下列问题: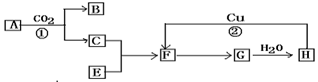
(1) 写出下列各物质的化学式: A.__________ E_________
(2)写出图中编号的化学方程式:
①_______________________②_________________________
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
⑥ |
⑦ |
bl |
|||||
| 三 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 四 |
② |
④ |
⑨ |
(1)11种元素中,化学性质最不活泼的是________。
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是________。
(3)元素⑦的氢化物分子式为________,该氢化物与元素①的单质反应的离子方程式是_______________________________________________。
(4)①的最高价氧化物对应的水化物的化学式为__________。①和⑨两元素形成化合物的化学式为_________________________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为。