A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________ (5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、______晶体
(7)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。 (8)用电子式表示B的硫化物的形成过程:_____________________________________
(8)用电子式表示B的硫化物的形成过程:_____________________________________
(12分,每空3分).
请回答下列问题:
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H=KJ·mol-1;
某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是。
(2)该反应中,发生还原反应的过程是→。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为。
(8分,每空1分)下列各组物质:① O2和O3② H2、D2、T2③12C和14C④CH3OCH3和CH3CH2OH⑤乙炔和丁炔⑥淀粉和纤维素
其中(1)互为同系物的是,(填序号,序号不重复使用,下同)
(2)互为同分异构体的是,
(3)互为同位素的是,
(4)互为同素异形体的是,
A、B、C、D、E是原子序数依次增大的五种短周期元素,A的某种核素不含中子,B、E同主族,且E的L层电子数是K层和M层电子数之和,C是所有短周期元素中半径最大的元素、C、D、E三种元素的最高价氧化物对应水化物两两之间均可反应。试解答下列问题:
(1)B元素的简单离子的结构示意简图为
(2)A、D、E元素的名称分别为、、。
(3)E元素在周期表中的位置是第周期族。
(4)五种元素的简单离子半径从大到小的顺序是(用元素离子符号填写)
(5)五种元素中,得电子能力最强的是,失电子能力最强的是(填元素符号)
下表是元素周期表的前三周期:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 一 |
A |
|||||||
| 二 |
B |
C |
D |
E |
F |
|||
| 三 |
G |
H |
I |
J |
回答下列问题:
(1)写出下列元素的元素的符号:F______________、J_____________。
(2)G元素与E元素形成的化合物的化学式是____________、____________,它们都是_________________(填“离子”或“共价”)化合物。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________,属于两性氢氧化物的是_______________(用化合物的化学式表示)。
(4)只含有A、C两种元素的化合物称为_____________,这些化合物中:
①相对分子质量最小的是________________,该化合物的分子空间构型是_______________;
②分子中含有双键,但原子数最少的是______________,它与HCl反应的化学方程式为______________________________;
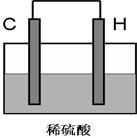
(5)将H单质与C的一种单质(导体)按如下图装置连接,该装置称为_____________。其中C极为______________,(填正负极)并写出该电极反应式为:____________________。请在下图中标出电子流动方向。