在200 mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2 mol·L-1,Cl-的物质的量浓度为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需要加入4 mol·L-1 NaOH溶液的体积为
| A.40 mL | B.72 mL | C.80 mL | D.128 mL |
根据如图所示的反应判断下列说法中错误的是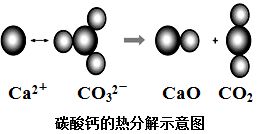
| A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 |
| B.该反应的焓变大于零 |
| C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
| D.由该反应可推出凡是需要加热才发生的反应均为吸热反应 |
下表中物质的分类组合正确的是
| A |
B |
C |
D |
|
| 强电解质 |
Al2(SO4)3 |
BaSO4 |
HF |
KClO3 |
| 弱电解质 |
H3PO4 |
H2O |
CaCO3 |
Al(OH)3 |
| 非电解质 |
CO2 |
NH3·H2O |
NH3 |
HI |
在水溶液中,因发生水解反应而不能大量共存的一组离子是
| A.CO32-、OH-、Na+、H+ | B.Al3+、Na+、AlO2-、Cl- |
| C.Ba2+、HCO3-、K+、SO42- | D.S2-、H+、SO42- 、Cu2+ |
反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
| A.用A表示的反应速率是0.4 mol/(L·min) |
| B.用B表示的反应速率是0.3 mol/(L·min) |
| C.2 min末时的反应速率,用B表示是0.3 mol/(L·min) |
| D.在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大 |
下列各反应中,生成物总能量比反应物总能量高的是
| A.工业合成氨 | B.铁生锈 | C.木炭燃烧 | D.电解饱和食盐水 |