下列反应中,反应后固体物质增重的是
| A.氢气通过灼热的CuO粉末 | B.二氧化碳通过Na2O2粉末 |
| C.铝与Fe2O3发生铝热反应 | D.将锌粒投入Cu(NO3)2溶液 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L CCl4含有0.1 NA个CCl4分子 |
B.1.5molCu和足 量稀硝酸反应产生NA个NO分子 量稀硝酸反应产生NA个NO分子 |
| C.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| D.18gD2O含有的质子数为10NA |
下列说法中正确的是
| A.铁是人类最早使用的金属,铁的应用,经历了“铁—普通钢—不锈钢等特种钢”的演变过程 |
| B.黑色金属材料及其它们的合金是应用最广泛的金属材料 |
| C.金属镁有“国防金属”的美誉,也被誉为“21世纪的金属” |
| D.铜绿的主要成分是碱式碳酸铜,这是铜在潮湿空气中发生电化学腐蚀的结果 |
下列叙述正确的是
A.浓硫酸的装运包装箱应贴上如图所示的标识 |
| B.用25ml酸式滴定管量取20.00ml0.01 mol·L-1的Na2CO3溶液 |
| C.能使湿润的淀粉一碘化钾试纸变蓝的气体一定是Cl2 |
| D.从含I-的溶液中提取碘可以先加入稀硫酸与3%的H2O2溶液,再用酒精萃取 |
下列有关化学用语使用正确的是
A.硫原子的原子结构示意图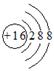 |
| B.乙烯的结构简式CH2CH2 |
| C.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++H++SO42- |
D.质子数为53,中子数为78的碘原子: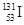 |
德国重离子研究中心于2010年2月19日宣布,以国际纯粹与应用化学联合会确认,由该中心合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”。选择2月19日为新元素正式冠名日,也是因为这一天是哥白尼的生日,有报道称Cn原子含有165个中子。下列有关112号元素的相关说法正确的是
A.该原子可表示为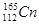 |
| B.该元素应位于元素周期表的第7周期ⅡB族 |
| C.该元素的相对原子质量为277 |
| D.该原子能够稳定存在 |