下列离子方程式正确的是( )
| A.少量金属钠加到冷水中:Na+2H2O===Na++2OH-+H2↑ |
B.NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO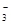 ===CaCO3↓+H2O ===CaCO3↓+H2O |
C.硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO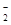 +4NH +4NH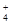 +2H2O +2H2O |
D.将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合:2Al3++7OH-===Al(OH)3↓+ AlO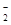 +2H2O +2H2O |
X、Y、Z分别是短周期元素的三种单质,它们都是常见的金属或非金属。M、N、R是常见的三种氧化物。其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):
(1)X+Z→N;
(2)M+X→N;
(3)M+Y→R+X。
若X是非金属,则组成Y单质的元素在周期表中的位置是( )
| A.第二周期ⅣA族 | B.第二周期ⅥA族 |
| C.第三周期ⅡA族 | D.第三周期ⅣA族 |
R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同。下列叙述正确的是( )
| A.Z与M形成的化合物中不可能含有非极性键 |
| B.对应氢化物的热稳定性:X>Y>M |
| C.单质的还原性:R>M>Y>X |
| D.X、Y、M、Z四种元素组成的离子化合物受热易分解 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍也是Y原子最外层电子数的3倍。下列说法正确的是( )
| A.Y与Z形成的简单离子核外电子排布相同 |
| B.X的氧化物为离子化合物 |
| C.Z的氢化物的水溶液在空气中容易变质 |
| D.X与Z对应的氧化物的水化物一定为强酸 |
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为常见的10电子分子。下列说法不正确的是( )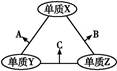
| A.X元素位于ⅥA族 |
| B.A不能溶解于B中 |
| C.A和C不可能发生氧化还原反应 |
| D.B的沸点高于C的沸点 |