下列有关Fe2(SO4)3溶液的叙述正确的是( )
| A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2 |
| C.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe |
D.和Ba(OH)2溶液反应的离子方程式:Fe3++SO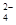 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓ +Ba2++3OH-===Fe(OH)3↓+BaSO4↓ |
国家环保总局宣布从2004年1月1日起,全国机动车的尾气排放标准实施相当于欧洲Ⅱ号标准。下列不属于汽车尾气排放的主要污染物的是
| A.氮氧化合物 | B.一氧化碳和未燃烧的碳氢化合物 |
| C.含铅化合物 | D.氨气 |
在图示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大。则气体X与液体Y
不可能是
| A |
B |
C |
D |
|
| 气体X |
NH3 |
SO2 |
CO2 |
HCl |
| 液体Y |
水 |
浓NaOH |
稀H2SO4 |
水 |
下列物质既能与稀硫酸又能与烧碱溶液反应的是
| A.NH4Cl | B.NaHCO3 | C.FeS | D.NaHSO4 |
下列有关硅及其化合物的说法错误的是
| A.硅的导电性能介于导体和绝缘体之间,是良好的半导体材料 |
| B.二氧化硅属于酸性氧化物,不能与任何酸反应 |
| C.硅酸可通过可溶性硅酸盐与其他酸反应制得,硅酸干凝胶常用作干燥剂 |
| D.硅酸钠的水溶液俗称水玻璃,可作木材防火剂 |
纯铁的熔点为1535℃,而高炉中炼铁时生铁在1200℃左右就熔化了,这是因为
| A.铁的纯度越高,熔点越低 |
| B.合金的熔点比其成分物质的熔点高 |
| C.形成了铁碳合金,所以熔点变低 |
| D.在高炉中熔化的过程中发生了化学反应 |