(10分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1 mol。
| 阳离子 |
K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 |
OH- HCO3- CO32- Cl- NO3- SO42- |
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。
(1)溶液中______(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是________________。
(2)原溶液中所含的阴离子为__________,阳离子为__________。
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为__________________。
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为__________g。
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应
SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。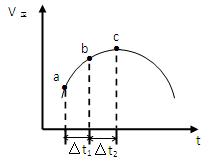
(1)点a-c段,速率变化的主要原因是,点c后速率变化的主要原因是。
(2)c点是否已经达到平衡状态(填“是”、“否”或“不一定”)
(3)反应物浓度:a点b点(填“<”、“=”或“>”)
(4)反应物的总能量生成物的总能量(填“<”、“=”或“>”)
(5)△t1=△t2时,SO2物质的量的变化量:a~b段b~c段(填“<”、“=”或“>”)
写出下列反应的热化学方程式:
(1)已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,写出能表示该反应燃烧热的热化学方程式
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出445kJ的热量。____________________________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、
c kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________
(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。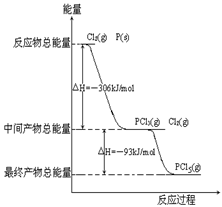
①P和Cl2反应生成PCl3的热化学方程式
②PCl5分解成PCl3和Cl2的热化学方程式_______________________
(14分)近年来,我闽许多地区气候异常现象频发,如:云南持续几个月的干旱、北方频发的沙尘暴等,使环境问题再次成为公众的焦点 是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)下列做法中,有利于降低大气中的 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。
a.直接用煤做燃料
b.开私家车
c.棺树造林以增加绿化面积
d.研究、幵发太阳能使之走进寻常百姓家
(2 )用CO和H2做原料可以合成甲醇,作为液体燃料。已知:

请写出用合成气(CO和H2)合成1mol液态甲醇的热化学反应方程式:__________
(3) 利用电化学原理将CO、SO2R化为重要化工原料,装置如图所示:
①若A为CO,B为H2, C为CH3OH,则通入CO的一极为_____极
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:__________
(4) ①已知:密闭容器中, 条件下,
条件下,
 ,其平衡常数K=13.3。
,其平衡常数K=13.3。
当此反应达到平衡时,若 ,则
,则 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体屮 ,
, ,则改变的条件是____________________
,则改变的条件是____________________
(14分)有关含铬化众物的相互转化关系如下:
回答下列问题:
(1 )上述反位中属于氧化还原反位的是_________ (填编号),
(2) 工业上处理含 的废水时,一般将剧毒的
的废水时,一般将剧毒的 转化为
转化为 ,以碳为阴极,铁作阳极,电解处理含
,以碳为阴极,铁作阳极,电解处理含 的酸性废水。写出电极反应和溶液中进ff的反应的离子方程式:_______________
的酸性废水。写出电极反应和溶液中进ff的反应的离子方程式:_______________
阳极:____________________;
阴极:____________________
(3) 上图中有一种微粒M有两性,该微粒是_______________分别写出该微粒与强酸和强碱反应的离子方程式:______________________________
( 14分)(I )某校化学兴趣小组用如下图所示过程除去AlCl3中含有的 杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
①写出混合物屮加人足虽氢氧化钠溶液时.溶液屮发生反应的离.子方程式:__________
②溶液a中存在的阴离子有__________;在溶液a中加人盐酸时需控制溶液的PH的原因是__________为此改讲方法是_______________
(2 )该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
下列有关判断中不正确的是()(填代号)
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸.则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室屮方案II更便于实施 |