氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如下图表达。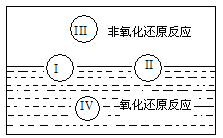
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:___________________,其中水为________剂
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl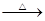 ____Cu+____CuCl2+N2↑+____H2O。
____Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10, 10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
液氨与水的电离相似,存在微弱的电离:NH3+NH3 NH4++NH2-。对该体系的说法中错误的是
NH4++NH2-。对该体系的说法中错误的是
| A.液氨中c(NH4+)与c(NH2—)的乘积为一常数 |
| B.液氨电离达到各微粒的浓度保持不变 |
| C.只要不加入其它物质c(NH4+)=c(NH2-) |
| D.液氨中存在NH3、NH4+、NH2-、H2O、NH3·H2O等粒子。 |
H+浓度都为0.01mol/L的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是
| A.醋酸与锌反应放出氢气多 |
| B.盐酸与锌反应放出氢气多 |
| C.醋酸与锌反应速率大 |
| D.盐酸和醋酸分别与锌反应速率一样大 |
在某温度下,0.01 mol·L-1 NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是
| A.由水电离出的c(H+)相等 |
| B.由水电离出的c(H+)都是1.0×10-12 mol·L-1 |
| C.由水电离出的c(OH-)都是0.01 mol·L-1 |
| D.两者都促进了水的电离 |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
| C.混合溶液中,c(H+)= mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
25 ℃时,水的电离达到平衡:H2O  H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw增大 |
| C.降温,使平衡左移,c(H+)减小,溶液呈碱性 |
| D.将水加热,Kw增大,pH减小 |