.查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。
试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
(2)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(3) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2 B.Fe C.H2O2 D.HNO3
(4)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:_____________________________________________。
(5)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_______________________________________。
12.4g Na2X中含Na+ 0.4mol,则Na2X的摩尔质量是,X的相对原子质量是。
(9分)如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。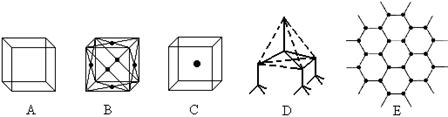
(1)其中代表金刚石的是(填编号字母,下同),其中每个碳原子与个碳原子最接近且距离相等。
(2)其中代表石墨的是,其中每个正六边形占有的碳原子平均为个。
(3)在NaCl晶体中,每个Na+周围与它最接近且距离相等的Na+有个。
(4)代表CsCl的是,它属于晶体,每个Cs+与个Cl-紧邻。
(5)干冰晶体中每个CO2分子与个CO2分子紧邻。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应式:,负极反应式:。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ |
1.9 |
3.2 |
| Fe2+ |
7.0 |
9.0 |
| Cu2+ |
4.7 |
6.7 |
| 提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu |
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下: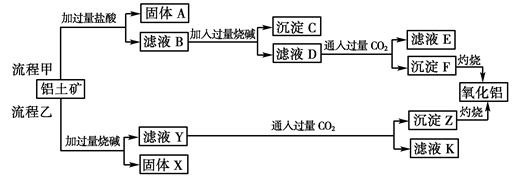
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为。
(2)流程乙加入烧碱后生成SiO32—的离子方程式为。
(3)验证滤液B含Fe3+,可取少量滤液并加入(填试剂名称)。
(4)滤液E、K中溶质的主要成份是(填化学式),写出该溶液的一种用途
。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=。
. A 、B、 C、 D、 E是中学常见的5种化合物,A 、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是
(2)若试剂1和试剂2均是稀硫酸。
①如何验证D中的金属离子已全部转化为E:
②物质C溶于水有净水作用,原因是:
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠
为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
(3)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是