下列离子组在一定条件下能共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
Fe2+、NO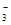 、K+ 、K+ |
稀硫酸 |
3Fe 2++NO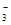 +4H+===3Fe3++NO↑+2H2O +4H+===3Fe3++NO↑+2H2O |
| B |
Fe3+、I-、ClO- |
氢氧化钠溶液 |
Fe3++3OH-===Fe(OH)3↓ |
| C |
Ba2+、HCO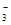 、Cl- 、Cl- |
氢氧化钠溶液 |
HCO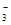 +OH-===CO +OH-===CO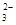 +H2O +H2O |
| D |
Al3+、Cl-、NO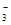 |
过量氢氧化钠溶液 |
Al3++3OH-===Al(OH)3↓ |
已知:25°C时,Ksp﹝Mg(OH)2﹞=5.61×10-12,Ksp﹝MgF2﹞=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,Mg(OH)2固体在20 ml 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的小 |
| C.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
| D.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物的相对分子质量为17,W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
| D.Z元素形成的某种单质有漂白性 |
常温下,在25mL 0.1 mol·L-1 NaOH溶液中逐滴加入a mL 0.2 mol·L-1 CH3COOH溶液,有关混合溶液的判断正确的是
| A.当pH=7时,一定有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| B.当a=25时,一定有:c(CH3COO-)+c(CH3COOH)=c(Na+) |
| C.当c(CH3COO-)>c(Na+)时,a一定大于12.5 |
| D.当c(OH-)>c(H+)时,a一定小于12.5 |
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:
Pb (s)+PbO2 (s)+2H2SO4 (aq)=2PbSO4 (s)+2H2O (l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是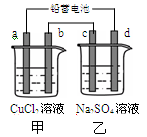
| A.d极为阴极 |
| B.放电时铅蓄电池负极的电极反应式为:PbO2 (s)+4H+(aq)+SO42-(aq)+4e-=PbSO4 (s)+2H2O (l) |
| C.若利用甲池精炼铜,b极应为粗铜 |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
| A.平衡时X、Y的转化率相同 |
B.该反应的化学方程式为:X(g)+Y(g) 2Z(g) 2Z(g) |
| C.T ℃时,若起始时X为2.00 mol,Y为2.00 mol,达平衡时Y的体积分数与原平衡Y的体积分数相同 |
| D.达到平衡后,将容器体积扩大为4 L,平衡向逆反应方向移动 |