实验室将NaClO3和Na2SO3按物质的量之比1∶2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g) R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是
| A.P、Q、R、S的浓度相等 | B.P、Q、R、S在容器中共存 |
| C.P、Q、R、S的浓度不再变化 | D.P、Q的消耗速率相等 |
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液,B不易腐蚀。将A、D在稀盐酸中构成原电池,电流由A通过导线流向D。将铜浸入B的盐溶液中,无明显变化。如果把铜浸入C的盐溶液中,有金属C析出。这四种金属的活动性由强到弱的顺序是
A.DCAB B.DABC C.DBAC D.BADC
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是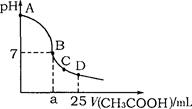
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
下列实验不能达到预期目的的是
| 代号 |
实验 |
实验目的 |
| A |
Cl2、Br2分别与H2反应 |
比较氯与溴的非金属性强弱 |
| B |
同温下测定相同浓度的Na2CO3, 和Na2SO4溶液的酸碱性 |
比较硫酸与碳酸的酸性强弱 |
| C |
AlCl3、MgCl2溶液中通人过量氨气 |
比较镁与铝单质的还原性强弱 |
| D |
同温下用同一电路分别测定同浓度的 盐酸和某一元酸溶液导电能力 |
比较该一元酸与盐酸酸性的强弱 |
在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=12" n(B)时,可断定x=4