高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH ="=" 2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.制备高铁酸钾用ClO-作还原剂 |
| B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 |
| D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体 |
工业上常将铬镀在其他金属表面,同铁.镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,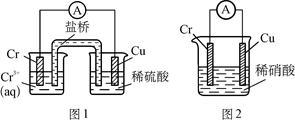
铬电极上产生大量有色气体,则下列叙述正确的是( )
| A.图1为原电池装置,Cu电极上产生的是O2 |
| B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+ |
| C.由实验现象可知:金属活动性Cu>Cr |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
实验表明,相同温度下,液态纯硫酸的导电性强于纯水。已知液态电解质都能像水那样自身电离而建立电离平衡(如H2O+H2O H3O++OH-),且在一定温度下都有各自的离子积常数。25 ℃时,纯硫酸的离子积常数K和水的离子积常数Kw关系为( )
H3O++OH-),且在一定温度下都有各自的离子积常数。25 ℃时,纯硫酸的离子积常数K和水的离子积常数Kw关系为( )
| A.K>Kw | B.K=Kw | C.K<Kw | D.无法比较 |
设nA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A.7 g CnH2n中含氢原子数为nA |
| B.4.6 g NO2.N2O4混合气体中含有中子数为2.3nA |
C.在反应5NH4NO3 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为15 nA 2HNO3+4N2↑+9H2O中,每生成4 mol N2,转移电子数为15 nA |
| D.电解精炼铜时每转移nA个电子,阳极溶解32 g铜 |
氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下几种说法,正确的组合是( )
①正极反应为O2+4e-+4H+===2H2O ②负极反应为2H2+4OH--4e-===4H2O
③电池工作时正极区pH升高,负极区pH下降 ④电池工作时溶液中的阴离子移向正极
| A.①②③ | B.②③ | C.②④ | D.①④ |
下列叙述正确的是( )
| A.水的离子积Kw随温度.外加酸(碱)浓度的改变而改变 |
| B.能自发进行的化学反应,一定是ΔH<0.ΔS>0 |
| C.当弱电解质电离成离子的速率与离子结合成分子的速率相等时达到电离平衡状态 |
| D.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中的离子浓度有关 |