36.5gHCl溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数,则下列叙述正确的是
| A.所得溶液的物质的量浓度:c=1mol·L-1 |
| B.所得溶液中含有NA个HCl分子 |
| C.36.5g HCl气体在标准状况下占有的体积约为22.4L |
| D.所得溶液的质量分数:w=36.5c/ρ |
“纳米材料”是粒子直径为1nm~100nm的材料。纳米碳就是其中的一种,某研究所将纳米碳均匀的分散在蒸馏水中,得到的物质是①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过半透膜 ⑤不能透过滤纸 ⑥静止后会出现黑色沉淀
其中正确的是
| A.①④⑥ | B.②③⑤ | C.②③④ | D.①③④⑥ |
NA表示阿伏加德罗常数。下列说法正确的是
| A.标准状况下11.2L的水中含有0.5NA个水分子 |
| B.22.4LN2所含的电子数是14NA |
| C.常温常压下,1molN2和NO的混合气体中含2NA个原子 |
| D.含107gFe(OH)3的胶体中胶粒总数为NA个 |
将饱和的FeCl3溶液分别滴入下列液体中,能形成胶体的是
| A.冷水 | B.NaOH溶液 | C.沸水 | D.NaCl溶液 |
如图所示是分离混合物时常用的仪器、从左到右,可以进行的混合物操作分别是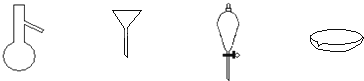
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是:
| A |
B |
C |
D |
|
| 物质 |
氢氧化钠 |
四氯化碳 |
金属汞 |
烟花爆竹 |
| 危险警告 标签 |
 |
 |
 |
 |