下列化学用语书写正确的是
A.NH3分子的结构式: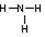 |
B.CO2分子模型的示意图: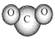 |
| C.乙烯分子的结构简式:CH2CH2 | D.Na2O的电子式: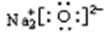 |
以NA表示阿伏伽德罗常数,下列说法中正确的是
①58.5 g氯化钠固体中含有NA个氯化钠分子;
②5.6 g铁粉与酸反应失去的电子数一定为0.2 NA;
③6.0 g金刚石中含有的共价键数为NA;
④标况下,11.2 L SO3所含的分子数为0.5 NA;
⑤1L 1 mol·L-1 AlCl3溶液中含有NA个胶粒Al3+;
⑥常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3 NA
| A.⑤⑥ | B.④⑤⑥ | C.③⑥ | D.①②③ |
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.铈(Ce)元素在自然界中主要以单质形式存在 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+ |
D.四种稳定的核素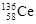 、 、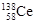 、 、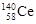 、 、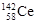 ,它们互称为同位素 ,它们互称为同位素 |
标况下有以下四种气体:①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
| A.体积:④<①<③<② | B.质量: ④<①<③<② |
| C.物质的量:①<②<③<④ | D.氢原子数: ②<④<③<① |
下列说法不正确的是
| A.葡萄糖能与新制的Cu(OH)2反应 | B.用酸性KMnO4溶液能鉴别乙烷和乙烯 |
| C.石油分馏所得的各馏分都是纯净物 | D.淀粉和纤维素水解的最终产物都是葡萄糖 |
元素X形成的简单离子与钙离子的核外电子排布相同,且X的简单离子半径大于氯离子的半径,则X元素为
| A.Mg | B.S | C.Ar | D.K |