25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是 ( )
| A.5×10-13 mol·L-1 | B.0.02 mol·L-1 |
| C.1×10-7 mol·L-1 | D.1×10-12 mol·L-1 |
下列各组单质中,前者能将后者从化合物中置换出来的是
①Al、Fe②C、Si③Mg、C④H2、Cu
A.只有①③B.只有②④C.①②③④D.只有①②④
乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有几种
| A.5种 | B.6种 | C.8种 | D.9种 |
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是
| A.分子总数为NA的SO2和CO2混合气体中含有的原子数为3NA |
| B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的氢原子数为4NA |
| C.常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为4 NA |
D.标准状况下,22.4L氧气与足量铁粉充分反应,转移的电子数为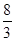 NA NA |
下列说法中正确的是
| A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 |
| B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金. |
| C.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂 |
| D.合成纤维和光导纤维都是高分子化合物 |
下列叙述中正确的是
| A.少量的钠通常保存在煤油中,少量白磷通常保存在水中 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质只能是氯气、臭氧、二氧化氮等气态物质 |
| C.要将溶解在CCl4中的碘分离出来,可以用蒸馏法,因为碘易升华,先分离出来 |
| D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有SO42- |