下列各组离子在溶液中一定能大量共存的是( )
A.pH=0的溶液中:ClO-、Cu2+、SO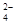 、K+ 、K+ |
| B.使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- |
C.能够和金属镁反应放出气体的溶液中:Na+、H+、SO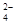 、Cl- 、Cl- |
| D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |
下列分离、提纯、鉴别物质的 方法正确的是
方法正确的是
| A.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D.用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
量取100mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4mL四氯化碳,用力振荡后静置,实验现象为
| A.液体分层,上层为四氯化碳层,黄色 | B.液体分层,上层为水层,紫色 |
| C.液体分层,下层为水层,黄色 | D.液体分层,下层为四氯化碳层,紫色 |
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中
| A.一定有SO42- | B.还可能有CO32- | C.一 定无Ag+ 定无Ag+ |
D.可能有SO42-或Ag+ |
配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是
| A.容量瓶中原有少量蒸馏水 | B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 | D.滴管加水时,有少量水滴到容量瓶外 |
某化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2
连接好线路发现灯泡亮,由此得出的结论正确的是
| A. NaCl是非电解质 |
| B. NaCl溶液是电解质。 |
| C. NaCl在水溶液中电离出了可以自由移动的离子。 |
| D. NaCl溶液中水电离出大量的离子 |