将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
| |
改变条件 |
新平衡与原平衡比较 |
| A |
增大压强 |
N2的浓度一定变小 |
| B |
升高温度 |
N2的转化率变小 |
| C |
充入一定量H2 |
H2的转化率不变,N2的转化率变大 |
| D |
使用适当催化剂 |
NH3的体积分数增大 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,1.42g Na2SO4含有的Na+离子数为0.01 NA |
| C.通常状况下,NA 个CO2分子含有原子数为3 NA |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
下列叙述正确的是
| A.1 mol H2O的质量为18g/mol | B.3.01×1023个SO2分子的质量为32g |
| C.CH4的摩尔质量为16g | D.44g CO2含有的O原子数为NA |
只用下列试剂中的一种就能鉴别AgNO3、Na2CO3、K2SO4三种溶液,则该试剂是
| A.KNO3溶液 | B.Na2SO4溶液 | C.NaOH溶液 | D.稀HCl |
现有三组溶液:①汽油和氯化钠溶液 ②70%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
| A.分液、蒸馏、萃取 | B.萃取、蒸馏、分液 |
| C.分液、萃取、蒸馏 | D.蒸馏、萃取、分液 |
下列叙述正确的是
| A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同 |
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中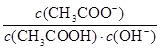 减小 减小 |
| C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH |
| D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-) |