对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
将5.6 g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入水中,剩余气体的体积为()mL
A.1120 B. 2240C.360 D.4480
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是()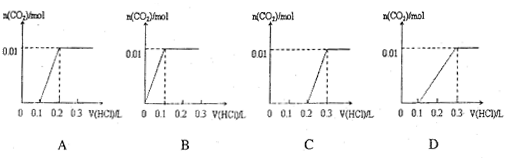
下列离子方程式正确的是()
| A.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2+ + 2Br- Cu +Br2 |
B.Na2S溶液水解:S2— + 2H2O H2S+2OH— H2S+2OH— |
| C.Fe(NO3)3的酸性溶液中通入足量硫化氢: 2Fe3++H2S=2Fe2++S↓+2H+ |
| D.H218O中投入Na2O2: |
2H218O+2Na2O2=4Na++4OH-+18O2↑
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是()
A. 、 、 、 、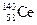 、 、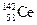 它们互称为同素异形体[ 它们互称为同素异形体[ |
| B.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| C.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑ |
| D.工业上金属铈一般保存在敞口容器中 |
关于下列图示的说法正确的是()
A.图①表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)中的△H大于0 CO2(g)+H2(g)中的△H大于0 |
| B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定 为1:1 |
| C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |