下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al ② NH3
Al ② NH3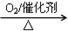 NO
NO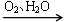 HNO3
HNO3
③NaCl(饱和)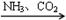 NaHCO3
NaHCO3 Na2CO3 ④FeS2
Na2CO3 ④FeS2 SO3
SO3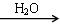 H2SO4
H2SO4
| A.②③ | B.①④ | C.②④ | D.③④ |
下列化学用语书写正确的是
A.氯原子的结构示意图: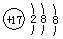 |
B.作为相对原子质量测定标准的碳核素: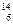 C C |
C.氯化镁的电子式: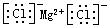 |
D.用电子式表示氯化氢分子的形成过程: |
下图是一种染料敏化太阳能电池的示意图。电池的一个点极由有机光敏燃料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: (激发态)
(激发态)
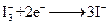
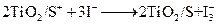
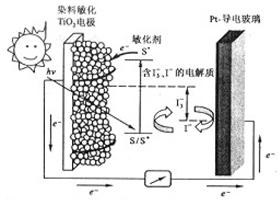
下列关于该电池叙述错误的是
| A.电池工作时,是将太阳能转化为电能 |
| B.电池中镀铂导电玻璃为正极 |
| C.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| D.电池的电解质溶液中I-和I3-的浓度不会减少 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.元素W和M的某些单质可作为水处理中的消毒剂 |
| C.元素Y的单质只能与氢氧化钠溶液反应而不能与任何酸反应 |
| D.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
下列离子方程式表达正确的是
| A.用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑ |
B.用惰性电极电解熔融氯化钠:2Cl-+2H2O Cl2↑+H2↑+OH- Cl2↑+H2↑+OH- |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O=H+ + Cl- +HClO |
| D.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH- + O2↑ |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
| A.X单质不易与水反应 | B.XO2可被碳或氢还原为X |
| C.XCl4的沸点比SiCl4的高 | D.XH4的稳定性比SiH4的高 |