常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH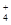 )> c(SO )> c(SO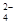 )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO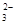 )+c(HCO )+c(HCO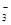 )+c(OH-) )+c(OH-) |
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO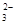 ) ) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中: |
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
下列推断或表述正确的是
A.某醋酸溶液的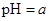 ,将此溶液稀释1倍后,溶液的 ,将此溶液稀释1倍后,溶液的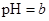 ,则 ,则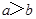 |
| B.向2.0mL浓度均为0.1 mol·L-1的KCl、KI混合液中滴1~2滴0.01 mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C.0.2 mol/L的一元酸HX与0.1 mol/L的KOH溶液等体积混合所得溶液中, 一定有:c(H+)+ c(K+)= c(OH-)+ c(X-) |
| D.室温下,0.2 mol?L-1盐酸与等体积0.05 mol?L-1 Ba(OH)2溶液混合后, |
溶液pH为1
下列有关有机物的说法正确的是
A.蛋白质、淀粉、纤维素、蔗糖都属于有机 高分子化合物 高分子化合物 |
| B.乙醇、乙酸、乙酸乙酯可以用饱和碳酸钠溶液鉴别 |
| C.乙烯和苯都可以和溴水发生化学反应 |
| D.可以用酒精萃取碘水中的碘 |
下图所示的实验方法、装置或操作完全正确的是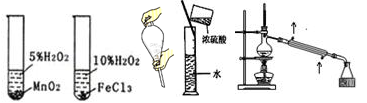
| A.稀释浓H2SO4 | B.萃取时振荡 | C.石油的蒸馏 | D.验证催化剂的效果 |
下列电极反应式与出现的环境相匹配的是
| 选项 |
电极反应式 |
出现的环境 |
| A |
O2 + 2H2O + 4e-= 4OH- |
碱性环境下氢氧燃料电池的负极反应 |
| B |
4OH- - 4e- = O2↑+ 2H2O |
弱酸性环境下钢铁的吸氧腐蚀 |
| C |
2H+ + 2e- =H2↑ |
用铜做电极电解NaOH溶液的阴极反应 |
| D |
H2 - 2e- = 2H+ |
用惰性电极电解H2SO4溶液的阳极反应 |
下列各项表述正确的是
A.次氯酸的电子式  |
| B.表示中和热的热化学方程式: NaOH(aq)+HF(aq)=NaF(aq)+H2O(l) △H=-57.3kJ/mol |
C.H2S的电离方程式为:H2S 2H++S2- 2H++S2- |
D.标准状况下,1.12L 和1.12L 和1.12L 均含有0.1 均含有0.1 个氧原子 个氧原子 |