下列化学方程式中有一个与其他三个在分类上不同,这个反应是
A.3Fe+2O2 Fe3O4 Fe3O4 |
B.C+ O2 2CO 2CO |
C.NH4HCO3 NH3↑+H2O+CO2↑ NH3↑+H2O+CO2↑ |
D.Na2CO3++H2O+CO2="2" NaHCO3 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是()
A.C(s)+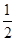 O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)ΔH=+571.6 kJ/mol |
C.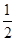 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定自发进行的是()
| A.ΔH>0,ΔS>0 | B.ΔH<0,ΔS<0 |
| C.ΔH>0,ΔS<0 | D.ΔH<0,ΔS>0 |
下列有关“电离平衡”的叙述正确的是()
| A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 |
| B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡 |
| C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 |
| D.电解质达到电离平衡后,各种离子的浓度相等 |
下列说法正确的是()
| A.物质的化学变化都伴随着能量变化 |
| B.凡是吸热反应都需要加热 |
| C.任何反应中的能量变化都表现为热量变化 |
| D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
已知NaHSO4在水中的电离方程式为:NaHSO4 = Na++H++SO42—。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是()
| A.该温度为常温25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积浓度为0.01 mol/L的NaOH溶液可使该溶液恰好呈中性 |