水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+)。对于这一过程,下列描述不合理的是______________。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
根据价层电子对互斥理论推测H3O+的形状为_____________________。
(2)水分子和硫化氢分子的键角及中心原子的杂化方式如下表:
| 分子 |
H2O |
H2S |
| 中心原子杂化方式 |
sp3 |
|
| 键角 |
104.5° |
92.1° |
| 键长 |
95.7 pm |
133.6 pm |
根据表格中的数据判断O-H键键能______(填“>”、“=”或“<”)S-H键键能。用电负性知识解释H2O的键角大于H2S的键角的原因:________________________
__________________________________________________________。
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是________kJ/mol。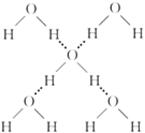
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。
.(共16分) 化合物Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ和Ⅳ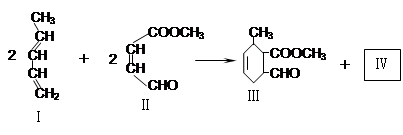
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
(1)a的结构简式是;②步的反应类型是。
(2)写出反应①的化学反应方程式该反应类型
(3)ⅰ、用甲醇与某有机物发生酯化反应可合成化合物Ⅱ,写出该反应的化学方程式
。
ⅱ、化合物Ⅱ与新制的氢氧化铜悬浊液反应的方程式
(4)化合物Ⅳ是Ⅲ的同分异构体,也有同样的六元环。Ⅳ的结构简式为。
已知2X2(g)+Y2(g) 2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
⑴此反应平衡常数表达式为______________;若将温度降低到300℃,则反应平衡常数将_____(填增大、减少或不变)。
⑵若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_______Wmol·L—1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
⑶能说明反应已达平衡状态的是___________________。
| A.浓度c(Z)=2c(Y2) | B.容器内压强保持不变 | C.v逆(X2)=2v正(Y2) | D.容器内的密度保持不变 |
⑷若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将_____(填“变大”、“变小”或“不变”)。
(10分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。请填写以下空白: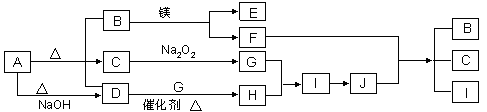
(1)A的化学式B的电子式。
(2)写出下列反应的化学方程式:
D+G→ H,
F+J → B + C + I。
(3)写出A+NaOH→D的离子方程式。
. 金晶体是面心立方体,立方体的每个面上5个金原子紧密堆砌(如图3,其余各面省略),金原子半径为A cm,求: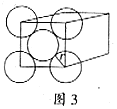
(1)金晶体中最小的一个立方体含有___________个金原子。
(2)金的密度为___________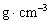 。(用带A计算式表示)
。(用带A计算式表示)
(3)金原子空间占有率为___________。(Au的相对原子质量为197,
用带A计算式表示)