向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| |
操作 |
现象 |
结论 |
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图的所示.下列描述正确的是
| A.从反应开始到10 s末,用Z表示的反应速率为0.158 mol/(L·s) |
| B.从反应开始到10 s末,用X表示的反应速率为0.79 mol/(L·s) |
| C.从反应开始到10 s末,Y的转化率为79.0% |
| D.该反应的化学方程式为X(g)+Y(g)=Z(g) |
对于反应2SO2(g)+O2(g)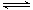 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
| A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D.乙池中的氧化产物为SO42- |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH—==IO3—+5I—+3H2O
下列说法不正确的是
| A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH— |
| B.电解结束时,右侧溶液中含有IO3— |
| C.电解槽内发生反应的总化学方程式KI+3H2O======KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-Cu2+ |