氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如下图,请结合化学用语 从化学平衡的角度解释: 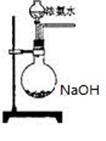
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。
首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。
已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.
写出氧化吸收法除去氮氧化物的化学方程式______________ _____
奶油中有一种只含
的化合物
。
可用作香料,其相对分子质量为88,分子中
原子个数比为2:4:1 。
(1)
的分子式为_。
(2)写出与
分子式相同的所有酯的结构简式:
。
已知:
中含有碳氧双键,与
相关的反应如下:
(3)写出
、
的反应类型:
、
。
(4)写出
、
、
的结构简式:
、
、
。
(5)写出
反应的化学方程式:。
(6)在空气中长时间搅拌奶油,
可转化为相对分子质量为86的化合物
,
的一氯代物只有一种,写出
的结构简式:。
的反应类型为。
、
、
、
、
、
是原子序数依次增大的六种常见元素。
的单质在
中燃烧的产物可使品红溶液褪色。
和
元素形成的化合物
具有磁性。
的单质在
中燃烧可生成
和
两种气体。
的单质是一种金属,该金属在
中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)
的单质分子的结构式为;
的电子式为;
元素在周期表中的位置是。
(2)
元素形成的同素异形体的晶体类型可能是(填序号)。
①原子晶体②离子晶体③分子晶体④金属晶体
(3)
、
、
形成的10电子氢化物中,
、
的氢化物沸点较低的是(写化学式);
、
的氢化物分子结合
能力较强的是(写化学式)_,用一个离子方程式加以证明。
(4)
气体通人
和
的混合溶液,生成白色沉淀和无色气体
,有关反应的离子方程式为_,由此可知
和
还原性较强的是(写化学式)。
(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
|
层上有2对成对电子 |
|
| 最外层电子数是次外层电子数的2倍 |
|
| 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
| 元素最高正价是+7价 |
(1)元素 的原子最外层共有种不同运动状态的电子。元素 的一种同位素可测定文物年代,这种同位素的符号是
(2)元素
与氢元素形成一种离子
,写出该微粒的电子式(用元素符号表示)
(3)元素
与元素
相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下
的单质和
的单质状态不同 b.
的氢化物比
的氢化物稳定
c.一定条件下
和
的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。
、
、
、
四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是,理由是。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| 单质能与水剧烈反应,所得溶液呈弱酸性 |
|
|
层
电子数比
电子数多2个 |
|
| 第三周期元素的简单离子中半径最小 |
|
|
层有三个未成对电子 |
(1)写出元素
的离子结构示意图。
写出元素
的气态氢化物的电子式(用元素符号表示)
(2)写出
元素最高价氧化物水化物的电离方程式
(3)元素
与氯元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下氯气的颜色比
单质的颜色深
b.
的单质通入氯化钠水溶液不能置换出氯气
c.氯与
形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-。
、
、
、
四种元素的单质中化学性质明显不同于其他三种单质的是,理由。
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
| X |
L层p电子数比s电子数多2个 |
| Y |
第三周期元素的简单离子中半径最小 |
| Z |
L层有三个未成对电子 |
(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂
。
请完成下列各题:
(1)写出反应类型:反应①反应④
(2)写出反应条件:反应③反应⑥
(3)反应②③的目的是:。
(4)写出反应⑤的化学方程式:。
(5)
被氧化成
的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(6)写出
的结构简式。