下列离子方程式正确的是
A.小苏打溶液中加入少量石灰水:HCO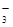 + Ca2+ + OH- = CaCO3↓ + H2O + Ca2+ + OH- = CaCO3↓ + H2O |
B.稀硝酸中加入过量铁粉: Fe + 4H++ NO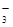 = Fe3++ NO↑ + 2H2O = Fe3++ NO↑ + 2H2O |
| C.溴化亚铁溶液中通入足量氯气:2Fe2++ 2Br-+ 2Cl2 = 2Fe3++ Br2 + 4Cl- |
D.苯酚钠溶液中通入少量二氧化碳: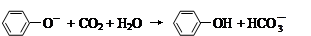 |
盐酸与块状CaCO3反应时,不能使反应的最初速率明显加快的是()
| A.将盐酸的用量增加一倍 | B.盐酸的浓度增加一倍,用量减半 |
| C.温度升高30 ℃ | D.改用更小块的CaCO3 |
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是()
| A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量 |
| B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ |
| C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量 |
| D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量 |
下面关于原电池的说法,正确的是()
| A.在正极上发生氧化反应 | B.化学性质较活泼的一极为负极 |
| C.在外电路中电子流出的极为正极 | D.原电池是将电能转化为化学能的装置 |
化学与以节能减排为基础的低碳经济密切相关。下列做法违背发展低碳经济的是
| A.城市采用分质供水,收集雨水进行综合利用 |
| B.大力发展汽车产业,鼓励市民购买家用汽车 |
| C.推广煤的气化、液化技术,提供清洁高效燃料 |
| D.开发利用太阳能、风能、氢能、核能等能源 |
构成下列四种物质的微粒间,既存在离子键又存在共价键的是()
| A.KOH | B.K2S | C.MgCl2 | D.SO3 |