【化学——选修2:化学与技术】
木糖醇(C5H12O5)可用作甜味剂、营养剂,在化工、食品、医药等工业中有广泛应用。利用玉米芯中的多糖可以生产木糖醇,其工艺流程如下:
1—浸泡罐;2、3—反应罐;4—板式过滤机;5、10—浓缩罐;
6—脱色柱;12—离心机(固液分离装置)
已知:木糖与木糖醇的转化关系如图: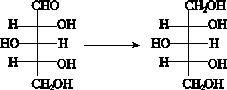
请回答下列问题:
(1)装置2中硫酸的主要作用是________。
(2)装置3中加入碳酸钙的目的是_____________________________________。
(3)为除去木糖浆中的杂质离子,7、8装置中的填充物依次是_____________________。
(4)装置9的作用是________。
| A.冷却木糖浆 | B.水解木糖 | C.氧化木糖 | D.还原木糖 |
(5)装置11的作用是________。