下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g) CO2(g) ΔH1
CO2(g) ΔH1
C(s)+O2(g) CO(g) ΔH2
CO(g) ΔH2
②S(s)+O2(g) SO2(g) ΔH3
SO2(g) ΔH3
S(g)+O2(g) SO2(g) ΔH4
SO2(g) ΔH4
③H2(g)+O2(g) H2O(l) ΔH5
H2O(l) ΔH5
2H2(g)+O2(g) 2H2O(l) ΔH6
2H2O(l) ΔH6
④CaCO3(s) CaO(s)+CO2(g) ΔH7
CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l) Ca(OH)2(s) ΔH8
Ca(OH)2(s) ΔH8
| A.① | B.④ | C.②③④ | D.①②③ |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液 有关量或性质的变化趋势,错误的是( )
有关量或性质的变化趋势,错误的是( )
在怛容条件下化学反应: 2SO2 ( g ) + O2 ( g )  2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是()
2SO3( g ) ;△ H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q)如下表所列:根据以上数据,下列叙述正确的是()
| 容器 |
SO2 (mol) |
O2(mol) |
SO3 (mol) |
Q(kJ·mol-1) |
| 甲 |
2 |
1 |
0 |
Q1 |
| 乙 |
1 |
0.5 |
0 |
Q2 |
| 丙 |
1 |
0.5 |
1 |
Q3 |
A.在上述条件下反应生成 lmolSO3固体放热Q/2 kJ
B.2Q1 <2Q2=Q1<Q
C.Ql ="2" Q2= 2Q3 = Q
D.2Q3 < 2Q2 < Q1 < Q
可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变
④恒温恒容时,密度保持不变
⑤NH3%不再改变⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存⑧N2、H2、NH3分子式之比为1:3:2
| A.全部 | B.只有①③⑤ | C.②③⑤⑥ | D.只有③⑤⑥ |
甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10 mol/L的乙酸。经测定它们的pH从大到小依次为a、乙酸、b。由此可知()
| A.b的浓度必大于乙酸的浓度 | B.a的浓度必大于乙酸的浓度 |
C.b的 浓度必小于乙酸的浓度 浓度必小于乙酸的浓度 |
D..a的浓度必小于乙酸的浓度 |
某温度下,已知反应mX(g)+nY(g) qZ(g)ΔH>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是( )
qZ(g)ΔH>0,m+n>q,在体积一定的密闭容器中投入反应物达到平衡,下列叙述正确的是( )
| A.通惰性气体增大压强,平衡正向移动 |
| B.再加入X,反应吸收的热量增大 |
| C.增加Y的物质的量,X的转化率减小 |
D.降低温度,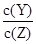 的值变小 的值变小 |