从如图所示的某气体反应的能量变化分析,以下判断错误的是( )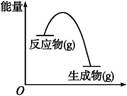
| A.这是一个放热反应 |
| B.该反应可能需要加热 |
| C.生成物的总能量低于反应物的总能量 |
| D.反应物比生成物更稳定 |
已知反应:① 2C(s)+O2(g)=2CO(g)ΔH= – 221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH= – 57.3 kJ·mol-1
下列结论正确的是()
| A.碳的燃烧热为△H = –110.5 kJ·mol-1 |
| B.反应①的△H < 0,△S > 0,则△G < 0,在任意温度下反应可自发进行 |
| C.反应①中反应物的总键能大于生成物的总键能 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ |
下列溶液一定呈中性的是()
A.c(OH-) = 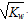 的溶液 的溶液 |
B.pH=7 的溶液 |
| C.c(H+) =10-14的溶液 | D.加甲基橙呈黄色的溶液 |
下列有关电解质的说法正确的是()
| A.CO2、SO2、NH3、Na2O溶于水能导电,所以它们是电解质 |
| B.BaSO4、AgCl在水中溶解度很小,所以是弱电解质 |
| C.向醋酸溶液中加入氢氧化钠固体,溶液导电性增强 |
| D.向氨水中加水后,溶液中所有离子浓度都减小 |
下列有关说法正确的是()
| A.工业生产硫酸时,接触室中采用高温高压条件都能提高SO2和O2的转化率 |
| B.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水 |
| C.阴离子交换树脂可以除去硬水中的Ca2+、Mg2+ |
| D.工业上电解熔融AlCl3可制金属铝 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。已知Fe + 2Fe3+= 3Fe2+,Cu + 2Fe3+= 2Fe2++Cu2+。则原混合物中单质铁的质量是()
| A.2.4 g | B.3.36 g | C.5.60 g | D.10.08 g |