用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和反应生成1 mol 水时放热( )
| A.55.2 kJ | B.391 kJ | C.336 kJ | D.1.38 kJ |
下列物质的体积约为22.4L的是
| A.标准状况下1mol H2O | B.20℃、101 kPa时36.5g HCl |
| C.常温常压下17g NH3 | D.标准状况下0.4 mol H2和0.6mol O2的混合气 |
下列物质属于纯净物的是
| A.液氯 | B.氯水 | C.盐酸 | D.漂粉精 |
下列叙述正确的是
| A.1molO2的质量为32g·mol-1 |
| B.1mol物质的质量等于该物质的相对分子质量或相对原子质量 |
| C.SO42-的摩尔质量为96 g·mol-1 |
| D.CO2的摩尔质量为44g |
在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是
A. |
B.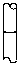 |
C. |
D. |
为中国近代化学发展做出突出贡献的科学家是
| A.李四光 | B.华罗庚 | C.候德榜 | D.钱学森 |