将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )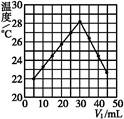
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约为1.00 mol·L-1 |
| D.该实验表明有水生成的反应都是放热反应 |
在密闭容器中发生反应: 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
A.平衡向逆反应方向移动
B.(a+b)>(c+d)
c.Z的物质的量变小
D.X的转化率变小
恒温、恒容的条件下对于 的反应,达到化学平衡状态的标志为
的反应,达到化学平衡状态的标志为
A.断开一个N  N键的同时有6个N-H键生成 N键的同时有6个N-H键生成 |
| B.混合气体的密度不变 |
| C.混合气体的平均相对分了质量不变 |
| D.N2、H2、NH3分子数之比为1:3:2的状态 |
反应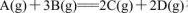 在四种不同情况下的反应速率分别为
在四种不同情况下的反应速率分别为 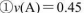
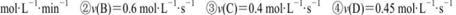 该反应进行的快慢顺序为
该反应进行的快慢顺序为
| A.④>③=②>① | B.④<③=②<① |
| C.①>②>③>④ | D.④>③>②>① |
下列说法不正确的是
| A.焓变是一个与反应能否自发进行有关的因素,放热反应具有自发进行的倾向 |
| B.在同一条件下物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| C.自发反应是指不需要条件就能发生的反应 |
| D.—个反应能否自发进行与焓变和熵变的共同影响有关 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
B.由C(石墨)=C(金刚石) 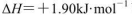 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定 |
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: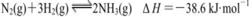 |
D.在稀溶液中,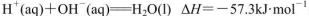 ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |