利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量? 。
(2)倒入NaOH溶液的正确操作是 (填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是 (填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1· ℃-1。为了计算中和热,某学生实验记录数据如下:
| 实验序号 |
起始温度t1/ ℃ |
终止温度t2/ ℃ |
|
| 盐酸 |
氢氧化钠溶液 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH= (结果保留一位小数)。
(6) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 。
某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在中(填写仪器编号)。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关、打开开关就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是。
A.用冷水洗B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗高锰酸钾溶液体积/mL |
25.52 |
25.02 |
24.98 |
则该产品纯度为。上表中第一次实验中记录数据明显大于后两次,其原因可能是。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应并获得反应液X。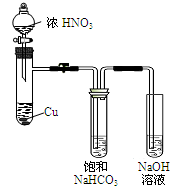
(1)①NaHCO3溶液呈碱性的原因是。
②Cu与浓硝酸反应的现象是。
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、、过滤。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
④甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想。但经讨论后认为不可行,你认为其原因是。
⑤乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则产物中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式。
⑥已知在酸性条件下NO2-能将I-氧化为I2。你认为能否用KI淀粉溶液检验X中是否存在NaNO2:_______(填“能”或“不能”),原因是。
⑦已知5NO2-+ 2MnO4-+6H+= 5NO3-+ 2Mn2+ +3H2O。称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是,则X中NaNO2的浓度是(用含a、b的式子表示)。
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下: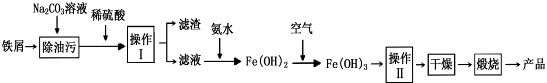
回答下列问题:
①操作II所包含的两项主要基本操作是。上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式:。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为:,该滴定过程中(填“是”或“否”)还需要指示剂。
实验步骤如下:
a.考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c.量取25.00mL待测溶液于锥形瓶中;
d.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需。
②某同学设计的下列滴定方式,最合理的是________(夹持部分略去)(填字母序号)。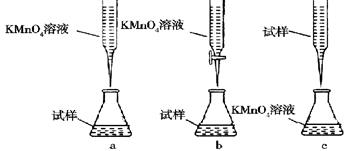
③计算上述样品中FeSO4·7H2O的质量分数为。
(共16分)硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用。它们对应的钠盐同样也是重要的化工产品。
(一)硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)= Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)= 3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:_______________________________。
装置D的作用是。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有。
a.烧杯b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是__________________。
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”)。
其原因是(用化学方程式表示)
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)→洗涤(并将洗涤液移入容量瓶)→→→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量0.4g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、、。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是。
②根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)
③如下图,排去碱式滴定管中气泡的方法应采用操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有(多选扣分)。
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.锥形瓶水洗后用待测稀盐酸溶液润洗
E.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗