在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/(mol·L-1) |
0.1 |
0.2 |
0 |
| 平衡浓度/(mol·L-1) |
0.05 |
0.05 |
0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为1 600
2Z(g),其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是()
| A.是一种新的氧化物 | B.不可能含有极性键 |
| C.是氧元素的一种同位素 | D.是臭氧的同分异构体 |
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是()
①H2O②NH3③Cl-④SCN-
| A.①② | B.①②③ | C.①②④ | D.①②③④ |
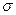 键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p 轨道和
键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p 轨道和 另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的
另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的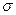 键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是()
键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是()
| A.H2 | B.HCl | C.Cl2 | D.F2 |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g);
2SO3(g);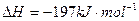 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
| 容器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量 :Q3 :Q3 |
下列叙述正确的是( )
)
| A.Q1=Q2=Q3="197" kJ |
| B.达到平衡时,丙容器中SO2的体积分数最大 |
| C.甲、乙、丙3个容器中反应的平衡常数相等 |
| D.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1 |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是()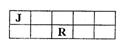
| A.J和氢组成的化合物分子中只含有极性共价键 |
| B.工业上用电解M和T组成的化合物来制备M |
| C.R、T两元素的气态氢化物中,T的气态氢化物更稳定 |
| D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |