氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。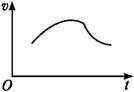
(1)反应开始时反应速率加快的原因是 ;
(2)反应后期反应速率减慢的原因是 。
下表表示的是元素周期表中短周期元素,根据要求回答下列问题:
| ⑧ |
|||||||
| ① |
② |
③ |
④ |
||||
| ⑤ |
⑥ |
⑦ |
(1)④⑥元素气态氢化物的稳定性比较> (写化学式)
(2)③号元素与其他元素可形成10个电子的阳离子和阴离子,其离子符号分别为、。
(3)用电子式表示⑧和③元素形成A2B型化合物的过程。
(4)用电子式表示⑤和⑥元素形成A2B型化合物的过程。
36 g的H2O 和 60 g 的D2O 中, 它们所含有的原子总数之比为,分子内的中子总数之比为,若它们分别与足量的金属钠反应, 产生的气体的质量之比为。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断: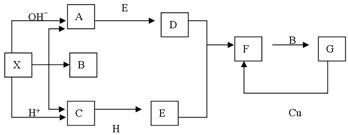
(1)化学式X;
(2)A的电子式为;空间构型;
C的结构式为;H所包含的化学键类型。
(3)工业上制取A的化学反应方程式;A→D的化学反应方程式;
C+H→E的化学反应方程式;G→D的离子反应方程式。
有一包白色固体,可能含有NaCl、Na2SO4、CaCl2、CuSO4、Na2CO3 和CaCO3 ,将固体放入水中,经搅拌后变为无色溶液;在溶液里加入BaCl2 溶液,产生白色沉淀,再加入盐酸,沉淀部分溶解并有气体放出,由此推断:
(1)原固体肯定有__________,(2)原固体肯定不存在_____________________。
(3)_____不能确定存在与否,要确定其存在,应进行的实验是___。
(1)(NH4)2SO4在强热条件下,可分解生成NH3、SO2、N2、H2O.
反应中氧化产物和还原产物的物质的量之比为。
(2)将K2S跟HNO3反应,生成NO、S、KNO3、H2O,反应的化学方程式为;氧化产物是;若生成2molNO,反应中电子转移的总物质的量为mol。