水的电离平衡曲线如图所示:
若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。
在密闭容器中进行可逆反应 CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),
CO2(g)+NO(g),(正反应放热),
达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
(2)通人CO2气体,平衡 移动。
(3)加入催化剂,平衡 移动。
(1)2SO2(g)+O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
①图中A点表示; C点表示;E的大小对该反应的反应热;(填“有”或“无”)影响。
②图中△H=kJ/mol。
(2)25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,则氢气的燃烧热的化学方程式为。
(3)①C(s) + O2(g) = CO2(g);ΔH = –393.5kJ/mol
②CO(g) + 1/2 O2(g) = CO2(g);ΔH = –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为。
一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: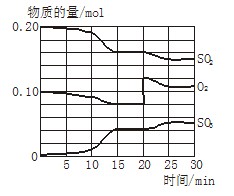
(1)降低温度,SO2的转化率_______,化学反应速度____ 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用
文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)该反应为(填“吸热”或“放热” )反应。
(2)该反应的化学平衡常数表达式为K=。
(3)能说明该反应达到化学平衡状态的是(填字母)。
a.容器中压强不变b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O)d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得c(CO) =" 0.0080" mol/L ,则CO2的转化率为。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。
又已知:H2O(g)=H2O(l) ΔH2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。