在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
| A.锌作阳极,镀件作阴极,溶液中含有锌离子 |
| B.铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C.铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| D.锌作阴极,镀件作阳极,溶液中含有锌离子 |
我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离
| A.苯和水 | B.乙酸乙酯和乙酸 |
| C.食盐水和泥沙 | D.硝酸钾和硫酸钠 |
在容积固定的容器中发生反应:A(g)+2B(g) 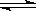 C (g)ΔH<0,各物质浓度如表所示:
C (g)ΔH<0,各物质浓度如表所示:
| 浓度 时间 |
c(A)/mol·L-1 |
c(B)/mol·L-1 |
c(C)/mol·L-1 |
| 0 |
0.8 |
1.6 |
0 |
| 2 min |
0.6 |
x |
0.2 |
| 4 min |
0.3 |
0.6 |
0.5 |
| 6 min |
0.3 |
0.6 |
0.5 |
下列说法错误的是
A.2~4 min内用B表示的平均反应速率为0.3 mol·L-1·min-1
B.反应在第2 min时改变了条件,可能是加入了催化剂
C.反应在第2 min时改变了条件,可能是增加了B的浓度
D.若加入催化剂,平衡时气体混合物的总物质的量保持不变
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)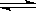 COS(g)+H2(g) K=0.1。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
| A.建立平衡过程中,CO减少的浓度大于H2S减少的浓度 |
| B.通入CO后重新达平衡,正、逆反应速率均增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
下列说法正确的是
| A.由H原子形成1 mol H—H键要吸收热量 |
| B.C(石墨,s) ="=" C(金刚石,s) ΔH=+1.9kJ/mol,则可判定金刚石比石墨稳定 |
C.500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 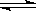 2NH3(g) ΔH=-38.6 kJ/mol 2NH3(g) ΔH=-38.6 kJ/mol |
| D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ/mol |
下列反应既符合图像Ⅰ又符合图像Ⅱ的是
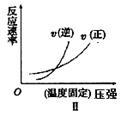
A.N2(g)+3H2(g) 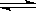 2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g) 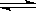 2SO2(g)+O2(g)ΔH>0 2SO2(g)+O2(g)ΔH>0 |
C.4NH3(g)+5O2(g) 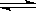 4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
D.C(s)+H2O(g) 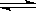 H2(g)+CO(g) ΔH>0 H2(g)+CO(g) ΔH>0 |