有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(S)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
已知常温下稀溶液中FeCl3水解方程式为:Fe3++3H2O Fe(OH)3+3H+,能使c(Fe3+)增大(溶液体积忽略不计)的是()
Fe(OH)3+3H+,能使c(Fe3+)增大(溶液体积忽略不计)的是()
| A.加入少量的H2SO4溶液 | B.加入少量NaCl溶液 |
| C.加热 | D.加入少量NaOH溶液 |
在相同温度下,在pH都是9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为amol/L与bmol/L,则a与b的关系为()
| A.a>b | B.a=10-4b | C.b=10-4a | D.a=b |
常温下,一定浓度的某溶液,由水电离出的c(OH-)=10-4mol/L,则该溶液中的溶质可能是()
| A.Al2(SO4)3 | B.CH3COONa | C.NaOH | D.KHSO4 |
已知25℃时,Ksp[Cu(OH)2]=2×10-20
(1)某CuSO4溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO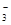 +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S===CuS↓+2H+ |
| C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑ |
| D.FeS+2H+===Fe2++H2S↑ |