室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )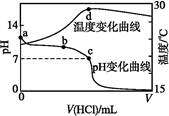
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c( NH4)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(N) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示。则下列对混合烃的判断正确的是()
①一定有C2H4②一定有CH4③一定有C 3H8
3H8
④一定没有C2H6⑤可能有C2H2⑥一定有C3H4
| A.②⑤⑥ | B.②④ | C.②④⑥ | D.②③ |
某烃分子中有一个由碳碳单键构成的六元环,有一个碳碳双键,还有一个碳碳叁键,则能满足上述条件的烃的分子式可能是()
| A.C8H8 | B.C10H16 | C.C12H22 | D.C14H22 |
下列文字表述与反应方程式对应且正确的是()
A.实验室制乙炔:CaC2+H2O →Ca(OH)2+C2H2↑
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C .乙醇和钠反应:CH3CH2OH + Na → CH3CH2ONa + H2↑
.乙醇和钠反应:CH3CH2OH + Na → CH3CH2ONa + H2↑
D.实验室用液溴和苯在催化剂作用下制溴苯: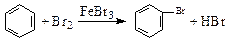
某气态烃0.5mol能与1molHCl加成,转变为氯代烷烃,加成后产物分子上的氢原子又可被3molCl2完全取代,则该烃可能是()
| A.CH≡CH | B.CH≡CCH3 | C.CH3C≡CCH3 | D.CH2=CHCH3 |
关于有机化学实验说法正确的是()
| A.用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 |
| B.热的苯酚浓溶液放入冷水中冷却,溶液变浑浊,此时发生了化学反应 |
| C.石油的分馏和煤的干馏都属于物理变化 |
| D.采用分液的方法分离甘油与水 |