某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )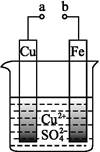
| A.a和b不连接时,铁片上会有金属铜析出 |
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e- Cu Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示, 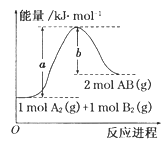
判断下列叙述中正确的是
| A.每生成2分子AB吸收bkJ热量 |
| B.该反应热△H=+(a-b)kJ·mol-1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1molA—A和1molB—B键,放出a kJ能量 |
某反应A + B =" C" + D 在低温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
| A.△H <0△S >0 | B.△H >0△S >0 |
| C.△H <0△S <0 | D.△H >0△S <0 |
下列有关说法中正确的是
| A.合成氨中采用及时分离氨气提高反应物的转化率 |
| B.升高温度能使吸热反应速率加快,使放热反应速率减慢 |
| C.增大压强,化学反应速率一定加快,平衡一定发生移动 |
| D.工业上电解饱和食盐水的阴极反应:2Cl--2e-===Cl2↑ |
在一定温度下,将气体X和气体Y各0.16 mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数比原平衡大
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
| A.70% | B.52.4% | C.47.6% | D.30% |